Вопрос 04
4. Диффузия липидных молекул в мембранах: латеральная, флип — флоп. Частота перескоков молекул. Люминесцентные методы изучения подвижности молекул в мембране, флуоресцентные метки и зонды.
Латеральная диффузия — это хаотическое тепловое перемещение молекул липидов и белков в плоскости мембраны. При латеральной диффузии рядом расположенные молекулы липидов скачком меняются местами, и вследствие таких последовательных перескоков из одного места в другое молекула перемещается вдоль поверхности мембраны. Среднее квадратичное перемещение S кв. молекул при диффузии за время t можно оценить по формуле Эйнштейна:
Перемещение молекул по поверхности мембраны клетки за время t определено экспериментально методом флуоресцентных меток — флюоресцирующих молекулярных групп. Флуоресцентные метки делают флюоресцирующими молекулы, движение которых по поверхности клетки можно изучать, например, исследуя под микроскопом скорость расплывания по поверхности клетки флюоресцирующего пятна, созданного такими молекулами.
Частота перескоков (число перескоков в секунду) молекулы с одного места на другое вследствие латеральной диффузии может быть найдена по формуле: гдеf — площадь, занимаемая одной молекулой на мембране.
Флип-флоп — это диффузия молекул мембранных фосфолипидов поперек мембраны.
Скорость перескоков молекул с одной поверхности мембраны на другую (флип-флоп) определена методом спиновых меток в опытах на модельных липидных мембранах — липосомах (см. § 5).
Часть фосфолипидных молекул, из которых формировались липосомы, метились присоединенными к ним спиновыми метками. Липосомы подвергались воздействию аскорбиновой кислоты, вследствие чего неспаренные электроны на молекулах пропадали: парамагнитные молекулы становились диамагнитными, что можно было обнаружить по уменьшению площади под кривой спектра ЭПР.
Таким образом, перескоки молекул с одной поверхности бислоя на другую (флип-флоп) совершаются значительно медленнее, чем перескоки при латеральной диффузии. Среднее время, через которое фосфолипидная молекула совершает флип-флоп (Т ~ 1 час), в десятки миллиардов раз больше среднего времени, характерного для перескока молекулы из одного места в соседнее в плоскости мембраны.
studfiles.net
Латеральная диффузия и флип флоп переход
Латеральная диффузия — это беспорядочное или тепловое перемещение молекул липидов и белков в плоскости мембраны. При этом расположенные рядом молекулы липидов последовательно меняются местами и вследствие таких скачков из одного места в другое молекула перемещается вдоль поверхности мембраны. Среднее квадратичное перемещение молекул при диффузии за время t можно оценивать по формуле Эйнштейна: Sкв = 2кор(Dt), где D — коэффициент лат. диффузии молекулы.
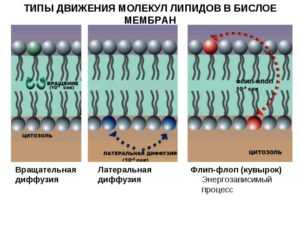
Другой тип движения молекул липидов в мембранных системах — это трансмембранное движение (флип-флоп-переход). Оно проходит в мембранах с довольно небольшой скоростью по причине высокого барьера для пересечения полярной головкой молекулы липида углеводородной зоны мембран (t = 1000 c).
Перескоки молекул с одной поверхности бислоя на другую (флип-флоп) происходят гораздо медленнее, чем перескоки при латеральной диффузии. Среднее время, через которое фосфолипидная молекула совершает флип-флоп (Т ~ 1 час), в десятки миллиардов раз больше среднего времени, характерного для перескока молекулы из одного места в соседнее в плоскости мембраны.
Условно выделяют три типа электростатических взаимодействий в мембранных системах: латеральное, или тангенциальное взаимодействие заряженных групп молекул, которые расположены в одном полуслое мембран; трансмембранное взаимодействие заряженных групп, расположенных по разные стороны мембраны; межмембранное взаимодействие заряженных групп, расположенных на поверхности двух соседних мембран.
luxeducation.ru
Флип-флоп переходы — Справочник химика 21
Флип-флоп переходы в липидах 10″ с [c.297] Таким образом, метод ЭПР применяют для изучения фазовых переходов в липидном бислое, микровязкости мембран, подвижности углеводородных цепей, латеральной диффузии и флип-флоп -переходов. Недостаток этого метода заключается в том, что введение зонда изменяет структуру бислоя и свойства мембраны. Метод ЭПР более чувствителен по сравнению с методом ЯМР, так как магнитный момент электрона в 1000 раз выше, чем ядра.
Различное поведение при малых и больших временах корреляции легко объяснимо. При больших временах корреляции преобладает вероятность перехода ]Уо . Она соответствует сохраняющим энергию флип-флоп переходам а/З /За. Эти переходы приводят к обмену энергией между двумя спинами, откуда и получаются положительные кросс-пики. При малых временах корреляции преобладает вероятность перехода приводящая к переходам аа /3/3. Отрицательная интенсивность кросс-пиков в этом случае объясняется тем, что спин с большей вероятностью теряет квант энергии, если второй спин тоже теряет квант. В результате наблюдается взаимное усш1ение релаксации, а не обмен намагниченностью. [c.614]
Другой тип движения молекул липидов в мембранных системах — это трансби-слойное движение (флип-флоп-переход). Оно осуществляется в мембранах с относительно малой скоростью вследствие высокого барьера для пересечения полярной головкой молекулы липида углеводородной зоны мембран. В модельных везикулярных мембранах скорость флип-флоп-перехода, оцененная по времени переноса половины количества молекул-меток из одного полуслоя в другой, составляет 10-20 ч и более. В природных мембранах этот процесс может идти существенно быстрее. В мембранах электрических органов угря это время составляет 3-7 мин, в мембранах эритроцитов — 20-30 мин. Отмечено, что при добавлении к мембранам клиновидных молекул, индуцирующих появление искривленных структур, а также при нарушении равновесного распределения молекул между слоями (например, при действии фосфолипаз) скорость флип-флоп-перехода резко возрастает. Очевидно, что сохранение ассиметричного распределения молекулярных компонентов в искусственных и природных мембранах возможно только при относительно медленной скорости флип-флоп переходов в этих системах. [c.24]
ПОЛ представляет собой один из важнейших универсальных процессов повреждения мембранных систем, изменяющий химический состав, физические параметры, ультраструктзфную организацию и функциональные характеристики биомембран. ПОЛ вызывает обновление липидного состава мембран вследствие удаления легко окисляющихся липидов — фосфатидилсерина, фосфатидилэтаноламина, фосфатидилинозитола. При ПОЛ возрастает скорость процессов флип-флоп -переходов. ПОЛ приводит к увеличению вязкости мембран в результате уменьшения содержания жидких липвдов в бислойных участках, появления поперечных межмолекулярных сшивок и возрастания доли упорядоченных липидов с ограниченной подвижностью. Отрицательный заряд на поверхности мембран увеличивается, что обусловлено вторичными продуктами ПОЛ (эпоксиды, кетоны, малоновый диальдегид и др.), содержащими карбонильные и карбоксильные группы. Мембраны эритроцитов, митохондрий, саркоплазматического ретикулума, лизосом становятся проницаемыми для различных ионов, неэлектролитов, макромолекул. Изменяются свойства мембранных белков Са -АТФазы, Ка , К — АТФазы, родопсина, фосфолипазы. Эти функциональные проявления ПОЛ определяют формирование многих патологических состояний организма, возникающих при неблагоприятных условиях и повреждающих воздействиях.
Метод ЯМР основан на резонансном поглощении в сильном внешнем магнитном поле энергии электромагнитного радиочастотного поля системой атомных ядер, обладающих магнитным моментом. Он позволяет получать сведения о подвижности молекул липидов биомембран, об упаковке фосфолипидных молекул в бислое, используется для регистрации изменений значения pH в частицах малого размера (искусственные мембраны, митохондрии), изучать процессы латеральной диффузии липидов и трансбислойного движения ( флип-флоп -переходы) молекул. [c.205]
Как исходное образование фосфатидиловой кислоты, так и ее последующие модификации с формированием различных типов молекул фосфолипидов происходят в той половине липидного бислоя ЭР, которая обращена к цитозолю. Этот процесс мог бы в конце концов превратить липидный бислой в монослой, если бы не существовало механизма для переноса части вновь образованных молекул фосфолипидов в другую половину бислоя ЭР. В искусственных липидных бислоях липиды не сов ерш ают таких флип-флоп -переходов. В ЭР же количество фосфолипидов выравнивается с двух сторон мембраны за минуты, что почти в 100000 раз быстрее, чем скорость, рассчитанная для спонтанного флип-флопа . Полагают, что столь быстрое перемещение поперек бислоя происходит при участии транслокаторов фосфолипидов, которые специфичны для каждого их типа (в зависимости от головной группы). По-видимому, в мембране ЭР имеется транслокатор ( флип-паза ), который способен переносить холин-содержащие фосфолипиды (но не этаноламин-, серии- или инозитол-содержащие) из одной половины бислоя в другую. Это означает, что ФХ достигает внутренней поверхности бислоя гораздо легче, чем ФЭ, ФС или ФИ. Таким образом транслокатор отвечает за асимметричное расположение липидов в бислое (рис. 8-57).
chem21.info
Липиды флип-флип — Справочник химика 21
Кроме этого, молекулы белков и липидов очень быстро вращаются вокруг своих продольных осей (вращательная диффузия). Перескок липидных молекул из одного монослоя в другой (флип-флоп) осуществляется редко, а белки, по-видимому, к такому перескоку вообще не способны. Причина исключительно медленного флип-флопа заключается в его энергетической невыгодности, поскольку необходимо перенести полярную головку молекулы липида через гидрофобную область бислоя. Подвижность липидных молекул тесно связана с фазовыми переходами в мембране, т. е. изменением ее состояния из жидкокристаллического в кристаллическое (или гелеобразное). Основным фактором, вызывающим фазовые переходы мембранных липидов, является изменение температуры среды. Значение температуры, при которой происходит переход данного липида из кристаллического в жидкокристаллическое состояние (и обратно), называется температурой фазового перехода гель — жидкий кристалл (рис. 22.4).Кроме этого молекулы белков и липидов очень быстро вращаются вокруг своих продольных осей вращательная диффузия). Перескок липидных молекул из одного монослоя в другой флип-флоп) осуществляется редко, а белки, по-видимому, к такому перескоку, вообще, не способны (рис. 2.6). Причина исключительно медленного флип-флопа заключается в его энергетической невыгодности, поскольку необходимо перенести по- [c.36]
Флип-флоп переходы в липидах 10″ с [c.297]
Строгая организованность липидного слоя мембраны не лишает его большой динамичности, которая возникает из-за передвижения липидных молекул в пределах мембраны, т.е. за счет интрамолекулярных движений липидов в пределах бислоя. Известно по крайней мере четыре типа интрамолекулярных движений липидов в пределах мембраны латеральная диффузия, вращательная диффузия, вертикальные колебания и упоминавшийся выше так называемый флип-флоп. [c.103]
Липиды, входящие в состав мембранного бислоя, не закреплены жестко, а непрерывно меняются местами. Перемещения липидных молекул бывают двух типов 1) в пределах своего монослоя (латеральная диффузия) и 2) путем перестановки двух липидных молекул, противостоящих друг другу в двух монослоях ( флип-флоп ). При латеральной диффузии молекулы липидов претерпевают миллионы перестановок в секунду, а скорость ее составляет 5—10 мкм/с. Перестановки молекул липидов из одного монослоя в другой происходят значительно реже, но могут ускоряться мембранными белками. [c.14]
В жидкокристаллич состоянии липидные молекулы способны легко мигрировать вдоль пов-сти бислоя Коэф лат альной диффузии липидов лежит в пределах 10″ -10 mV При переходе бислоя в гелевое состояние скорость такой диффузии резко падает Миграция липидных молекул с одной стороны бислоя на другую (т наз олип-флоп) происходит медленно Полупериод флип-олопа составляет неск часов или даже дней, что обусловлено необходимостью преодоления высокого энергетич барьера при переносе полярной головки липидной молекулы через гидрофобную область бислоя [c.597]
Молекулы липидов очень легко обмениваются местами и соседними молекулами в одном монослое, но очень редко мигрируют из одного монослоя в другой. Латеральная диффузия в плоскости одного монослоя происходит очень быстро каждая молекула обменивается местом с соседней со скоростью 10 раз в секунду, тогда как обмен молекул между монослоями двойного слоя по флип-флоп механизму происходит менее чем раз в две недели. При появлении лизофосфатов, диольных фосфолипидов и окисленных липидов скорость флип-флопового обмена значительно повышается. [c.39]
Как исходное образование фосфатидиловой кислоты, так и ее последующие модификации с формированием различных типов молекул фосфолипидов происходят в той половине липидного бислоя ЭР, которая обращена к цитозолю. Этот процесс мог бы в конце концов превратить липидный бислой в монослой, если бы не существовало механизма для переноса части вновь образованных молекул фосфолипидов в другую половину бислоя ЭР. В искусственных липидных бислоях липиды не сов ерш ают таких флип-флоп -переходов. В ЭР же количество фосфолипидов выравнивается с двух сторон мембраны за минуты, что почти в 100000 раз быстрее, чем скорость, рассчитанная для спонтанного флип-флопа . Полагают, что столь быстрое перемещение поперек бислоя происходит при участии транслокаторов фосфолипидов, которые специфичны для каждого их типа (в зависимости от головной группы). По-видимому, в мембране ЭР имеется транслокатор ( флип-паза ), который способен переносить холин-содержащие фосфолипиды (но не этаноламин-, серии- или инозитол-содержащие) из одной половины бислоя в другую. Это означает, что ФХ достигает внутренней поверхности бислоя гораздо легче, чем ФЭ, ФС или ФИ. Таким образом транслокатор отвечает за асимметричное расположение липидов в бислое (рис. 8-57). [c.55]
Аксиальное вращение липидных молекул происходит очень быстро с частотой порядка 10 -10 «S тогда как латеральная диффузия осуществляется гораздо медленнее. Тем не менее при среднем коэф, латеральной диффузии липидов ок. 10 см -с , измеренном для мн. М.б., липидной молекуле потребуется всего 1 с, чтобы промигрировать от одного конца клетки до другого. Очень медленно протекает в липидном бислое флип-флоп. Обычно полупериод флип-флопа составляет величины порядка неск. часов или даже дней. Однако в нек-рых мембранах скорость флип-флопа м. б. значительно выше (полупериод 1-2 мин), что объясняется участием определенных интегральных белков в переносе липидных молекул через мембрану. [c.30]
Топологическое распределение лнпндов тесно связано с их межмембранным обменом, а также с трансмембранной миграцией. В модели Синджера — Николсона подрвзумепается. что асимметричное распределение лнпндов сохраняется, поскольку молекулы липидов чрезвычайно медленно переходят с одной стороны мембраны на другую. Однако исследования последних лет показали, что скорость флип-флопа в биологических мембранах может быть очень велика (полупериод — 1—2 мин), причем это ускорение вызывается действием некоторых интегральных мембранных белков. [c.586]
Тот факт, что протеины и липиды асимметрично распределены и ориентированы в биомембранах, оказывает большое влияние на перенос вещества. Как протеины, так и липиды сохраняют свою односторонность, т. е. для них не характерны перестановки флип-флоп в бислое. Однако протеины способны участвовать в латеральном движении в пределах своего монослоя. Такая облегченная латеральная диффузия, вероятно, связана с гидрофобной природой мембранных протеинов (по сравнению с водорастворимыми протеинами), которая, в свою очередь, приводит к относительно слабым взаимодействиям. Латеральная диффузия также обусловлена наличием дефектных структур, которые становятся особенно заметными вблизи температуры фазового перехода. Установлено, что асимметрия протеинов возникает в процессе биосинтеза. Протеины, которые находятся на внешней поверхности клетки (экзопротеины), как правило, содержат углеводы, а протеины, которые находятся на внутренней (цитоплазматической) поверхности клеточных мембран (эндопротеины), их не содержат. Углеводороды, по всей вероятности, стабилизируют или блокируют экзопротеины, и по ним также можно опознавать поверхность клетки. Большая часть протеинов располагается на внутренней, а не на внешней поверхности бислоя. [c.326]
Толщина мембраны обычно составляет 4—10 нм. Состав мембран существенно зависит от их функций и типа клеток, однако во всех случаях основными составляющими являются липиды и белки, соотношение между которыми колеблется от 0,4 до 2,5. Липидная часть мембраны состоит из триацилглицеринов, стероидов, фосфо- и сфинголипидов (см. главу 7). Основу мембраны составляет липидный бислой, в котором гидрофильные концы фосфолипидов обращены к молекулам воды внутри и снаружи клетки, а гидрофобные хвосты жирных кислот — внутрь мембраны хвост к хвосту . Отдельные участки мембраны, образованные липидами с высоким содержанием насыщенных жирных кислот, находятся в жестком состоянии, другие участки, где содержится больше ненасыщенных жирных кислот, более пластичны. Холестерин, содержащийся между ацильными цепями липидного бислоя, препятствует его кристаллизации, т. е. поддерживает состояние текучести. Таким образом, мембрана не является статическим образованием, а благодаря жидкокристаллической структуре представляет собой двухслойный раствор, в котором часть липидов и белков способна диффундировать перпендикулярно или параллельно поверхности мембраны первый (перпендикулярный) вид перемещения известен как флип-флот-иерескок. [c.442]
Другой тип движения молекул липидов в мембранных системах — это трансби-слойное движение (флип-флоп-переход). Оно осуществляется в мембранах с относительно малой скоростью вследствие высокого барьера для пересечения полярной головкой молекулы липида углеводородной зоны мембран. В модельных везикулярных мембранах скорость флип-флоп-перехода, оцененная по времени переноса половины количества молекул-меток из одного полуслоя в другой, составляет 10-20 ч и более. В природных мембранах этот процесс может идти существенно быстрее. В мембранах электрических органов угря это время составляет 3-7 мин, в мембранах эритроцитов — 20-30 мин. Отмечено, что при добавлении к мембранам клиновидных молекул, индуцирующих появление искривленных структур, а также при нарушении равновесного распределения молекул между слоями (например, при действии фосфолипаз) скорость флип-флоп-перехода резко возрастает. Очевидно, что сохранение ассиметричного распределения молекулярных компонентов в искусственных и природных мембранах возможно только при относительно медленной скорости флип-флоп переходов в этих системах. [c.24]
Изучение меченых липидных молекул в изолированных биологических мембранах и относительно простых целых клетках, таких как микоплазма, бактерии и эритроциты, показало, что поведепие липидных молекул в клеточных мембранах в основном сходно с поведепием зтих молекул в искусственных бислоях. Липидный компонент биологической мембраны представляет собой двумерную жидкость, в которой отдельные молекулы липидов могут свободно передвигаться в плоскости мембраны. Как и в синтетических бислоях, индивидуальные молекулы липидов обычно не выходят за пределы своего мопослоя. Однако существуют исключения в таких мембранах, в которых липиды активно синтезируются (например, в мембранах эидоплазматического ретикулума) должен идти быстрый флип-флоп специфических липидов. Для ускорения этого процесса имеются даже специальные мембраносвязанные ферменты — транслокаторы фосфолипидов (см. разд. 8.6.14). [c.353]
Динамическая структура липидного бислоя наиболее полно изучена на примере искусственных бислойных везикул. Эти исследования показали, что молекула фосфолипида как целое может вращаться вокруг своей продольной оси и имеет достаточно высокую подвижность в слое с коэффициентами латеральной диффузии 10 —10 см /с. Полярные головки образуют на поверхности короткоживу-щие (10 —10 с) кластеры из 20—30 молекул, в результате чего могут возникать временные дефекты в структуре бислоя. Диффузия молекул воды через липидный бислой возможна при их попадании в эти свободные объемы между гидрофобными хвостами липидов. Молекулы фосфолипидов, находясь в бислое, могут осуществлять перескок из одного слоя в другой (флип—флоп). Однако в искусственных бислойных мембранах это происходит сравнительно редко из-за энергетической невыгодности переноса полярной головки через гидрофобный слой (Оеепеп, 1981). Только селективное взаимодействие с интефальными белками природных мембран может обеспечить быстрый переход фосфолипида из одного слоя в другой. Например, из печени быка был выделен белок, селективно взаимодействующий с ФХ и транспортирующий его с внешней стороны мембраны на внутреннюю, из искусственных везикул в плазматическую мембрану. После гидролиза этого комплекса был [c.110]
ПОЛ представляет собой один из важнейших универсальных процессов повреждения мембранных систем, изменяющий химический состав, физические параметры, ультраструктзфную организацию и функциональные характеристики биомембран. ПОЛ вызывает обновление липидного состава мембран вследствие удаления легко окисляющихся липидов — фосфатидилсерина, фосфатидилэтаноламина, фосфатидилинозитола. При ПОЛ возрастает скорость процессов флип-флоп -переходов. ПОЛ приводит к увеличению вязкости мембран в результате уменьшения содержания жидких липвдов в бислойных участках, появления поперечных межмолекулярных сшивок и возрастания доли упорядоченных липидов с ограниченной подвижностью. Отрицательный заряд на поверхности мембран увеличивается, что обусловлено вторичными продуктами ПОЛ (эпоксиды, кетоны, малоновый диальдегид и др.), содержащими карбонильные и карбоксильные группы. Мембраны эритроцитов, митохондрий, саркоплазматического ретикулума, лизосом становятся проницаемыми для различных ионов, неэлектролитов, макромолекул. Изменяются свойства мембранных белков Са -АТФазы, Ка , К — АТФазы, родопсина, фосфолипазы. Эти функциональные проявления ПОЛ определяют формирование многих патологических состояний организма, возникающих при неблагоприятных условиях и повреждающих воздействиях. [c.106]
Метод ЯМР основан на резонансном поглощении в сильном внешнем магнитном поле энергии электромагнитного радиочастотного поля системой атомных ядер, обладающих магнитным моментом. Он позволяет получать сведения о подвижности молекул липидов биомембран, об упаковке фосфолипидных молекул в бислое, используется для регистрации изменений значения pH в частицах малого размера (искусственные мембраны, митохондрии), изучать процессы латеральной диффузии липидов и трансбислойного движения ( флип-флоп -переходы) молекул. [c.205]
В последнее время значительное внимание привлекают исследования передвижения липидных молекул в пределах мембраны. Имеется, по крайней мере, четыре интрамолекулярных движения липидов в бислое латеральная диффузия — движение в плоскости бислоя, вращательная диффузия вокруг продольной оси молекул, ртцкальные колебания липидных молекул, переход липидных молекул из одного монослоя в другой (флип-флоп). Эти движения делают бимолекулярный слой липидов необычайно динамичным. Методами ЭПР и ЯМР показано, что переход фосфолипидных молекул из одного монослоя в другой протекает очень медленно. На все типы молекулярных движений липидных молекул сильное влияние оказывает состоя+1ие, в котором в данный момент находятся липиды бислоя, т. е. фазовые переходы липидов, переход их из гелеобразного в жидкокристаллическое состояние. [c.82]
chem21.info
флоп — Справочник химика 21
Чтобы рассмотреть взаимосвязь между подвижностью молекул, составляющих бислой, и его функцией, мы должны подробнее обсудить формы такой подвижности. Это колебания и вращение отдельных групп или боковых цепей липидных молекул, а также латеральная диффузия целых липидных молекул в своем монослое. Липидная молекула в липосоме меняется местами с соседними молекулами 10 раз/с. Однако ее переход с одной стороны бислоя на другую сторону совершается только один раз в 14 сут. Этот так называемый флип-флоп , или третий тип подвижности, практически не вносит вклада в подвижность мембраны. [c.74]
Механизм действия спинового катализатора в рассмотренном примере состоит во взаимном флип-флоп перевороте спина катализатора и радикала. Действие спинового катализатора можно иллюстрировать с помощью векторной модели, представленной на рис. 1. [c.68]
Константу скорости встреч можно рассчитать, например, с помощью формулы Смолуховского. Надо только иметь в виду, что взаимный флип-флоп переворот спинов катализатора и любого из двух радикалов пары одинаковым образом приводит к S-T конверсии РП. Поэтому при расчете Kq надо еще ее умножить на 2. Эффективность флип-флоп переворотов спинов при столкновении двух парамагнитных частиц найдена для целого ряда систем при изучении спинового обмена [3]. [c.70]
В результате флип-флоп переворота спины переходят в состояние ( = Л п- [c.70]
Флип-флоп перевороты спинов индуцируются обменным взаимодействием [c.70]
Аксиальное вращение липидных молекул происходит очень быстро с частотой порядка 10 -10 «S тогда как латеральная диффузия осуществляется гораздо медленнее. Тем не менее при среднем коэф, латеральной диффузии липидов ок. 10 см -с , измеренном для мн. М.б., липидной молекуле потребуется всего 1 с, чтобы промигрировать от одного конца клетки до другого. Очень медленно протекает в липидном бислое флип-флоп. Обычно полупериод флип-флопа составляет величины порядка неск. часов или даже дней. Однако в нек-рых мембранах скорость флип-флопа м. б. значительно выше (полупериод 1-2 мин), что объясняется участием определенных интегральных белков в переносе липидных молекул через мембрану. [c.30]
Время жизни двух партнеров в области эффективного обменного взаимодействия имеет некоторое распределение. Примем, что это время имеет пуассоновское распределение вида ехр(- /г), где т — среднее время жизни столкнувшихся партнеров в области взаимодействия, в области, где происходит взаимный флип-флоп спинов. Усредненная эффективность взаимного переворота двух спинов равна [c.71]
На практике во многих случаях идеальной эффективности переноса намагниченности достичь невозможно. Установление термодинамического равновесия между дипольными и зеемановскими резервуарами может быть чрезвычайно медленным, в частности когда Ви или Bis > Bl, что делает сохраняющие энергию флип-флоп процессы маловероятными. Поэтому адиабатический перенос требует очень медленного изменения РЧ-полей, так что за это время релаксация Tig может привести к необратимому спаду намагниченности. [c.238]
Кроме этого, молекулы белков и липидов очень быстро вращаются вокруг своих продольных осей (вращательная диффузия). Перескок липидных молекул из одного монослоя в другой (флип-флоп) осуществляется редко, а белки, по-видимому, к такому перескоку вообще не способны. Причина исключительно медленного флип-флопа заключается в его энергетической невыгодности, поскольку необходимо перенести полярную головку молекулы липида через гидрофобную область бислоя. Подвижность липидных молекул тесно связана с фазовыми переходами в мембране, т. е. изменением ее состояния из жидкокристаллического в кристаллическое (или гелеобразное). Основным фактором, вызывающим фазовые переходы мембранных липидов, является изменение температуры среды. Значение температуры, при которой происходит переход данного липида из кристаллического в жидкокристаллическое состояние (и обратно), называется температурой фазового перехода гель — жидкий кристалл (рис. 22.4). [c.307]
Кроме этого молекулы белков и липидов очень быстро вращаются вокруг своих продольных осей вращательная диффузия). Перескок липидных молекул из одного монослоя в другой флип-флоп) осуществляется редко, а белки, по-видимому, к такому перескоку, вообще, не способны (рис. 2.6). Причина исключительно медленного флип-флопа заключается в его энергетической невыгодности, поскольку необходимо перенести по- [c.36]
Поскольку соседних спинов значительно больше (например, в первой кубической сфере число соседей равно 26), вероятность флип-флопа хотя бы одного соседа существенно больше вероятности кросс-релаксационного перехода выделенного спина. Таким образом, за счет [c.199]
Флип-флоп переходы в липидах 10″ с [c.297]
Возможен еще один механизм спин-спиновой релаксации. Предположим, что два ядра одного и того же изотопа Л и , имеющие антипараллельные спины, оказались в непосредственной близости друг к другу. Поскольку оба ядра прецес-сируют с точно одинаковой частотой, то при соответствующем согласовании фаз может произойти резонансное взаимодействие между ними, состоящее в одновременной переориентации обоих ядер (флип-флоп процесс). Такой процесс называют еще диполь-дипольным взаимодействием. Общая энергия системы спинов ядер А и В при этом не изменяется. Время спин-спиновой релаксации обычно обозначают Т . [c.25]
Помимо движений отдельных участков липидной молекулы относительно друг друга в жидкокристаллич, бислое происходят также движения всей молекулы как единого целого. Они включают аксиальное вращение молекулы вокруг ее длинной оси, перпендикулярной к плоскости бислоя, маятниковые и поплавочные колебайия молекулы относительно ее равновесного положения в бислое, перемещение молекулы вдоль бислоя (латеральная диффузия) и перескок ее с одной стороны бислоя на другой (флип-флоп). Все эти движения совершаются с разными скоростями. [c.30]
Различное поведение при малых и больших временах корреляции легко объяснимо. При больших временах корреляции преобладает вероятность перехода ]Уо . Она соответствует сохраняющим энергию флип-флоп переходам а/З /За. Эти переходы приводят к обмену энергией между двумя спинами, откуда и получаются положительные кросс-пики. При малых временах корреляции преобладает вероятность перехода приводящая к переходам аа /3/3. Отрицательная интенсивность кросс-пиков в этом случае объясняется тем, что спин с большей вероятностью теряет квант энергии, если второй спин тоже теряет квант. В результате наблюдается взаимное усш1ение релаксации, а не обмен намагниченностью. [c.614]
Топологическое распределение лнпндов тесно связано с их межмембранным обменом, а также с трансмембранной миграцией. В модели Синджера — Николсона подрвзумепается. что асимметричное распределение лнпндов сохраняется, поскольку молекулы липидов чрезвычайно медленно переходят с одной стороны мембраны на другую. Однако исследования последних лет показали, что скорость флип-флопа в биологических мембранах может быть очень велика (полупериод — 1—2 мин), причем это ускорение вызывается действием некоторых интегральных мембранных белков. [c.586]
В некоторых системах можно наблюдать дополнительные слабые линии, которые нельзя свести к запрещенным переходам типа показанных на рис. 7-7. Примером является атом водорода в таких облученных замороженных кислотах, как Н2504. Слабые линии в спектре ЭПР отделены от линий, соответствующих разрешенным переходам, резонансной частотой протона в поле Нг, используемом в спектрометрах ЭПР [140, 142]. Слабые линии обусловлены протонами матрицы, спин которых переворачивается ( флип-флоп ), когда происходит изменение ориентации электронных спинов атомов водорода в бли- [c.168]
Тот факт, что протеины и липиды асимметрично распределены и ориентированы в биомембранах, оказывает большое влияние на перенос вещества. Как протеины, так и липиды сохраняют свою односторонность, т. е. для них не характерны перестановки флип-флоп в бислое. Однако протеины способны участвовать в латеральном движении в пределах своего монослоя. Такая облегченная латеральная диффузия, вероятно, связана с гидрофобной природой мембранных протеинов (по сравнению с водорастворимыми протеинами), которая, в свою очередь, приводит к относительно слабым взаимодействиям. Латеральная диффузия также обусловлена наличием дефектных структур, которые становятся особенно заметными вблизи температуры фазового перехода. Установлено, что асимметрия протеинов возникает в процессе биосинтеза. Протеины, которые находятся на внешней поверхности клетки (экзопротеины), как правило, содержат углеводы, а протеины, которые находятся на внутренней (цитоплазматической) поверхности клеточных мембран (эндопротеины), их не содержат. Углеводороды, по всей вероятности, стабилизируют или блокируют экзопротеины, и по ним также можно опознавать поверхность клетки. Большая часть протеинов располагается на внутренней, а не на внешней поверхности бислоя. [c.326]
В 1979 г, было показано, что белки плазматической мембраны способны к вращательной диффузии — поворотам вокруг оси, перпендикулярной плоскости бислоя, и самопроизвосльному передвижению вдоль плоскости самой мембраны, что получило название «латеральной диффузии». Однако белки не могут совершать так называемые флип-флопы, т.е. перевертываться и перескакивать с одной стороны бислоя на другую. Латеральная диффузия позволяет мембранным белкам совершать перемещения по мембране и взаимодействовать между собой, а также обеспечивает распространение мембранных компонентов из мест их синтеза в другие области клеток. Текучая структура липидного бислоя дает возможность мембранам сливаться, не утрачивая способности к регуляции их проницаемости и реализации специфических функций. [c.56]
Скорость релаксации обычно характеризуется временем релаксации Г,, т. е. временем перехода от данного неравновесного заселения спиновых уровней к тепловому равновесному распределению. является мерой спин-решеточного взаимодействия, возвращающего систему к термодинамическому равновесию. Во многих случаях, но далеко не всегда, зависит от температуры и при некоторых обстоятельствах столь велико, что делает наблюдение эффекта JIMP невозможным уже при комнатной температуре. Ядерный магнитный резонанс позволяет получить ценную информацию о диффузионных явлениях в ионных кристаллах. Резонансные линии спектра ЯМР чувствительны к миграции ионов, на ядрах которых наблюдается резонанс. Хорошо известно, что при наличии подвижности молекул в образце, например, при переходе из кристаллического состояния в жидкое, сужение линий может достигать 10 [1]. Обычное уширение линий ЯМР в твердом теле связано с влиянием, оказываемым на данное ядро со стороны его соседей. Па ядро действуют магнитные поля соседних ядер, составляющая которых может быть ориентирована по направлению Но или в противоположную сторону. При этом истинное поле (Яоэфф) варьирует от ядра к ядру, с распределением, близким к гауссовому, максимум которого соответствует напряженности внешнего поля Но. Подобное размазывание поля приводит к размазыванию ларморовских частот и уширению фезонансной линии. Кроме того, спин-спиновое взаимодействие соседних ядер ( спин — флип — флоп — процесс) [c.221]
Другой тип движения молекул липидов в мембранных системах — это трансби-слойное движение (флип-флоп-переход). Оно осуществляется в мембранах с относительно малой скоростью вследствие высокого барьера для пересечения полярной головкой молекулы липида углеводородной зоны мембран. В модельных везикулярных мембранах скорость флип-флоп-перехода, оцененная по времени переноса половины количества молекул-меток из одного полуслоя в другой, составляет 10-20 ч и более. В природных мембранах этот процесс может идти существенно быстрее. В мембранах электрических органов угря это время составляет 3-7 мин, в мембранах эритроцитов — 20-30 мин. Отмечено, что при добавлении к мембранам клиновидных молекул, индуцирующих появление искривленных структур, а также при нарушении равновесного распределения молекул между слоями (например, при действии фосфолипаз) скорость флип-флоп-перехода резко возрастает. Очевидно, что сохранение ассиметричного распределения молекулярных компонентов в искусственных и природных мембранах возможно только при относительно медленной скорости флип-флоп переходов в этих системах. [c.24]
Изучение меченых липидных молекул в изолированных биологических мембранах и относительно простых целых клетках, таких как микоплазма, бактерии и эритроциты, показало, что поведепие липидных молекул в клеточных мембранах в основном сходно с поведепием зтих молекул в искусственных бислоях. Липидный компонент биологической мембраны представляет собой двумерную жидкость, в которой отдельные молекулы липидов могут свободно передвигаться в плоскости мембраны. Как и в синтетических бислоях, индивидуальные молекулы липидов обычно не выходят за пределы своего мопослоя. Однако существуют исключения в таких мембранах, в которых липиды активно синтезируются (например, в мембранах эидоплазматического ретикулума) должен идти быстрый флип-флоп специфических липидов. Для ускорения этого процесса имеются даже специальные мембраносвязанные ферменты — транслокаторы фосфолипидов (см. разд. 8.6.14). [c.353]
Холестерол уменьшает не только текучесть липидного бислоя, такое же действие он оказывает на его пропицаемость для малых водорастворимых молекул. Кроме того, холестерол увеличивает упругость и механическую прочность бислоя. Именно благодаря холестеролу мембрана может менять свою форму в ответ на приложенную к ней силу. Дело в том. что в отличие от фосфолипидов, холестерол может быстро перераспределяться между монослоями. Объясняется это тем, что маленькая полярная голова холестерола (гидроксильная группа) относительно легко проходит через центр бислоя, энергетический барьер для флип-флоп молекул холестерола оказывается низким, и, следовательно, его перераспределение осуществляется быстро. [c.354]
Динамическая структура липидного бислоя наиболее полно изучена на примере искусственных бислойных везикул. Эти исследования показали, что молекула фосфолипида как целое может вращаться вокруг своей продольной оси и имеет достаточно высокую подвижность в слое с коэффициентами латеральной диффузии 10 —10 см /с. Полярные головки образуют на поверхности короткоживу-щие (10 —10 с) кластеры из 20—30 молекул, в результате чего могут возникать временные дефекты в структуре бислоя. Диффузия молекул воды через липидный бислой возможна при их попадании в эти свободные объемы между гидрофобными хвостами липидов. Молекулы фосфолипидов, находясь в бислое, могут осуществлять перескок из одного слоя в другой (флип—флоп). Однако в искусственных бислойных мембранах это происходит сравнительно редко из-за энергетической невыгодности переноса полярной головки через гидрофобный слой (Оеепеп, 1981). Только селективное взаимодействие с интефальными белками природных мембран может обеспечить быстрый переход фосфолипида из одного слоя в другой. Например, из печени быка был выделен белок, селективно взаимодействующий с ФХ и транспортирующий его с внешней стороны мембраны на внутреннюю, из искусственных везикул в плазматическую мембрану. После гидролиза этого комплекса был [c.110]
chem21.info
В МЕМБРАНЕ
Количество просмотров публикации В МЕМБРАНЕ — 160
ПОДВИЖНОСТЬ МОЛЕКУЛЯРНЫХ КОМПОНЕНТОВ
Возможность изменения конфигурации цепей жирных кислот имеет большое значение для растворения в липидном слое и переноса через него различных молекул и ионов. Ион попадает в полость внутри липидного бислоя, образуемую за счёт соответствующих изгибов окружающих цепей жирных кислот.
Кинки
В результате такого вращения жирнокислотные цепи приобретают как бы гибкость, хотя на самом деле они не изгибаются в полном смысле этого слова, а лишь могут поворачиваться вокруг связей между атомами, что и приводит к изгибу молекулы в целом.
Атомы углерода в углеводородных цепях жирных кислот соединены между собой одинарными связями, вокруг которых, как на оси, разные участки цепи могут вращаться. Это вращение приводит к тому, что цепи могут находиться в самых различных конфигурациях (слайд 16)
ПОДВИЖНОСТЬ УГЛЕВОДОРОДНЫХ ЦЕПЕЙ ФОСФОЛИПИДНЫХ МОЛЕКУЛ В ЛИПИДНОМ БИСЛОЕ МЕМБРАН
За счёт изгиба цепей молекула фосфолипида частично утрачивает свою цилиндрическую форму и становится более сферической.
На плоскости возможные конфигурации фосфолипидной молекулы изобразить трудно, но некоторые из них для иллюстрациии приведены на слайде 17. Полностью вытянутая конфигурация (1) соответствует совершенно одинаковому расположению всех углеродных атомов друг относительно друга. Такая конфиигурация называеится полностью-транс конфигурацией. Альтернатива транс-конфигурации — это так называемая цис-конфигурация (2). В мембранах жирнокислотные цепи стиснуты соседними молекулами, и свободная форма клубка для фосфолипидной молекулы не реализуется. Распространена в связи с этим двойная гош-конфигурация (3), при которой углеводородная цепь остаётся вытянутой вдоль оси.
Такая полость принято называть кинком (от английского слова kink — петля, изгиб). Кинки образуются в результате теплового движения молекул и ион может перемещаться в липидном слое мембраны, перескакивая из одного кинка в соседний (слайд 18).
Гидрофобный эффект объединяющий молекулярные компоненты в мембранах, препятствует их выходу в водную фазу за пределы мембраны. В то же время силы межмолекулярного взаимодействия обычно не мешают молекулам в мембранах обмениваться друг с другом местами, поскольку площадь контакта между водой и гидрофобными участками при этом практически не изменяются. Вследствие этого молекулярные компоненты в мембранных системах сохраняют индивидуальную подвижность и могут диффузионным путем передвигаться в пределах мембраны.
Рассмотрим подвижность и типы движения базовых молекул, входящих в состав биологической мембраны.
Для измерения подвижности отдельных липидов и их частей используют разнообразные методы. Так к полярной головке липида можно присоединить ʼʼспиновую меткуʼʼ, к примеру нитроксильную группу (=N-О), имеющую неспаренный электрон. Спин этого электрона порождает парамагнитный сигнал, который обнаруживается методом электронного парамагнитного резонанса. Этот метод позволяет легко определить движение и ориентацию в бислое подобного спин – меченного липида. Такие опыты показали, что молекулы липидов легче всего осуществляют вращательные движения вокруг своей длинной оси. Время корреляции вращательного движения τс молекул (время поворотов на угол в 1) спин – меченых фосфолипидов, стеринов и жирных кислот в различных модельных и природных мембранах, находящихся в жидком составляет ≈10-9с. Вращательное движение имеет достаточно малое время корреляции и температуру ниже точки плавления жирно-кислотных цепей липидов в мембранах.
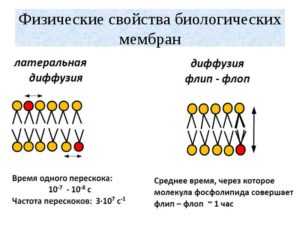
Латеральная диффузия. Липидные молекулы без труда меняются местами со своими соседями в пределах одного монослоя. Такое перемещение молекул обычно называют латеральной диффузией. Липидная молекула средних размеров диффундирует на расстоянии, равное длине большой бактериальной клетки (≈2 мкм), ≈ за 1с. Скорость латеральной диффузией существенно зависит от липидного состава мембран и температуры.
Флип-флоп переходы. Другой тип движения молекул липидов в мембранных системах — ϶ᴛᴏ трансбислойное движение (флип-флоп-переход). Исследование движения спин – меченых липидов показывают, что липидные молекулы в синтетических мембранах чрезвычайно редко пересказывают из одного монослоя мембраны в другой. Этот процесс имеет особое физиологическое значение, так как процесс биосинтез фосфолипидов и сборка мембраны протекают асимметрично. Активные центры ферментов биосинтеза фосфолипидов локализованы на одной, а не на двух сторонах мембраны. К примеру, фосфолипиды синтезируются и внедряются в мембрану на цитоплазматической стороне эндоплазматического ретикулума печени крысы и на внутренней стороне бактериальной цитоплазматической мембраны. Ясно, что эти липиды должны пересечь мембрану, чтобы достичь противоположной стороны бислоя.
Скорость трансмембранной миграции фосфолипидов в фосфолипидных везикулах пренебрежимо мала: ее характерное время составляет несколько суток или любая индивидуальная молекула липида осуществляет подобный флип-флоп-перескок реже, чем 1 раз в неделю. Такая малая скорость перехода связана с крайне важно стью преодолеть полярной головке липида углеводородную зону мембраны. Флип-флоп-переход может ускоряться в присутствии таких интегральных мембранных белков, как гликофорин, или при возмущениях в бислое, происходящих, к примеру, при обработке фосфолипазами.
При этом имеются мембраны, в которых миграция липидов протекает очень быстро, с характеристическим временем порядка нескольких минут. Такие данные по лучены для эндоплазматического ретикулума печени крысы, а также для цитоплазматической мембраны грамположительных бактерий В. megaterium. В этих мембранах происходит синтез липидов, и в них, по-видимому, присутствуют специальные транслоказы, которые обеспечивают быструю трансмембранную миграцию липидных молекул. Такое предположение было высказано в отношении эндоплазматического ретикулума, но оно пока не нашло экспериментального подтверждения. Характерное время трансмембранной миграции липидов в мембране эритроцитов имеет промежуточное значение и составляет величины порядка нескольких часов исходя из структуры изучаемого липида. Было установлено, что скорость миграции возрастает при нарушениях цитоскелета͵ а также под действием агентов, влияющих на структуру липидного бислои (к примеру, грамицидина А). Возможно, цитоскелет играет определенную роль в уменьшении скорости миграции липидов через бислои благодаря связыванию аминофосфолипидов. Характерно, что ни эндоплазматический ретикулум, ни бактериальная цитоплазматическая мембрана, для которых характерна высокая скорость флип-флопа перехода липидов, не связаны с цитоскелетом.
Литература:
1. Рубин А.Е. Биофизика. 2 том. М.Высшая школа, 2004.
2. Рыбин Н.И. Лекции по биофизике.Свердловск.СГУ,1990.
3. Антонов В.Ф.и др Биофизика. – М, 2000–
4. Геннис Р. Биомембраны. Молекулярная структура и функции. – М.: Мир, 1997 – 624 с.
5. Владимиров Ю.А. с соавт. Биофизика. М., Медицина, 1983.
Контрольные вопросы.
1. Почему врачу нужно знать основы мембранологии?
2. Какими методами изучают строение мембран и почему?
3. Для чего используют модельные системы?
referatwork.ru
Флип-Флоп втулки (fixed gear) | Интернет-журнал о велосипедах
Флип-Флоп (Flip-Flop) втулка, или «двухсторонние втулка», — втулка, с каждой стороны которой может быть установлена либо фиксированная шестерёнка, либо трещотка. При использовании таких втулок, звезда меняется при помощи переворота колеса на другую сторону. Существует несколько типов таких втулок. Их сновное назначение — возможность сменить тип привода простой перестановкой колеса. Как правило флип-флоп втулки устанавливают на фиксед-гир или сингл-спид велосипеды.
Фиксед-гир велосипеды
Как правило, на таких втулках на одной стороне резьба под звезду (cog), а на другой под фривил. Но можно найти втулки под звезды с обеих сторон, но это редкость и всего несколько фирм выпускают подобное (Phil Wood в США, Goldtec в Великобритании, Formula в Тайване). Сторона под звезду обладает особым диаметром, специально под локринг. Увеличенный диаметр позволяет установить стандартную заднюю звезду и фривил с другой стороны с таким же диаметром. По I.S.O. стандарт резьбы 1.375» х 24 tpi (шаг резьбы на дюйм), но в некоторых странах установлены свои стандарты (Великобритания — 1.370» х 24, Франция — 34.7 х 1 мм, Италия — 35 мм х 24).

Локринг необходим для закрепления звезды, чтобы при езде она не откручивалась. Для «левостроннего» локринга тоже существуют свои стандарты: Английский / ISO 1.29″ x 24 tpi, Campagnolo / Phil Wood 1.32″ x 24 tpi, Французкий (старый) 33 мм x 1.0 мм. Два первых самые распространенные, а французкий встречается гораздо реже. Обязательно смотрите под какой локринг подходит резьба втулки. Часто локринг с неправильно резьбой можно без проблем поставить на «не свою» втулку, но со временем резьба начнет изнашеваться, а затем разрушится.

Чаще всего на флип-флоп втулки ставят звезды и фривилы с большим или равным звезде количеством зубьев. Одинаковые размеры удобны, т.к. не меняют соотношение передач, но с другой, установка большей звезды позволяет легче преодолевать подъемы. Стандарты ISO для фривилом схожи с звездами для фиксед-гира. Обычный фривил для BMX’а с легкостью встанет на флип-флоп втулк. Если у вас нет возможности или желания купить трекову втулку, то вы можете поставить трековую звезду на обычную втулку, используя «правостороннюю» резьбу, а в качестве локринга сойдет локринг от каретки с английским ISO стандартом (их резьба совпадает). Но не стоит злоупотреблять этим, на пользу резьбе это точно не пойдет.

Трековые звезды бывают с различным количеством зубьев, от 12 до 23, и двух размеров 3/32″ и 1/8″ (толщина зубьев). 3/32″ создан для 3/32″ цепей, но подойдет и под 1/8″ (или даже более широких цепей для bmx или сингл-спидов). А вот звезды 1/8″ подходят только под соответствующие цепи. Вы можете поставить и цепь 3/16″ (для bmx), она подойдет под любую звезду с количество зубьев от 11 (или 16 для фривила). Фривилы бывают с 16-23 зубьями и также с разными размерами 3/32″ и 1/8″. Компания ACS выпускает «FAT» bmx-фривилы (14-16 зубов) только под цепь 3/16″ (есть варианты и под 3/32″).

BMX / Сингл-спид велосипеды
Под такие велосипеды существует несколько вариантов флип-флоп втулок, отличающихся от трековых. Большинство втулок для bmx имеют на одной стороне резьбу стандарта ISO и более тонкую на другой (30 мм х 1 мм), что позволяет установить фривилы с количеством зубьев 14 или 15. В настоящее время на рынке начали появляться и 13-зубные фривилы.
Следует знать, что существуют «правосторонние» и «левостронние» флип-флоп втулки. На одну сторону можно установить обычный «правосторонний» фривил, а на другую «левосторонний» (1.375″ x 24L tpi). Одной из первой моделью такого фривила был ACS South Paw Claw на 16t. DK Bicycles выпустили Dual Drive втулку с меньшим диаметром (30 мм х 1 мм) под 13-15t фривилы, с двумя адаптерами в комплекте (левый и правый), с уменьшенной резьбой и резьбой стандарта ISO.

Барабанные / Дисковые тормоза под тандем втулки
Это достаточно редкий вид втулок, которые не являются флип-флоп втулкой, но может использоваться как таковая. На таких втулках с обеих сторон резьба стандарта ISO 1.375″ x 24 tpi. На одну сторону такой втулки устанавливают барабанные или дисковые тормоза, а на другую многоскоростной фривил.

www.cyclepedia.ru
